https://prtimes.jp/data/corp/102047/logo/pc-715734321b82eabd54c0168d725ab7ed-2ed2d6c7d450ad563c37341ff3801252.jpeg
植物の活性酸素種生成酵素の活性化メカニズムを解明
-
活性酸素は、一般に毒性の高い物質と考えられていますが、植物は、活性酸素種生成酵素を持ち、活性酸素を積極的に生成して免疫や成長など多様な役割に活用しています。
-
毒性の高い活性酸素種を生成する酵素の活性は、厳密に制御される必要がありますが、その制御メカニズムには不明な点が多く残されていました。
-
本研究は、モデル植物ゼニゴケを用いて、活性酸素種生成酵素RBOHの基本的な活性化メカニズムを解明しました。
-
RBOHの活性化には、普遍的な細胞内シグナルの担い手であるカルシウムイオン(Ca2+)との結合が不可欠であり、陸上植物全般に保存された活性制御領域内の2つのアミノ酸残基がリン酸化されることによりCa2+が結合しやすくなり活性化されることを見出しました。
-
本研究成果は、陸上植物全般に敷衍できる可能性があり、植物の免疫や成長、生殖などを制御するための重要な基礎的知見になると期待されます。
【研究の概要】
東京理科大学大学院 創域理工学研究科 生命生物科学専攻の橋本 貴史氏(2023年度博士後期課程修了見込)、進藤 大輝氏(2018年度理工学研究科応用生物科学専攻修士課程修了)、東京理科大学創域理工学部生命生物科学科の橋本 研志助教、坪山 祥子ポストドクトラル研究員、朽津 和幸教授(創域理工学研究科 農理工学際連携コース 副コース長 併任)らの研究グループは、京都大学の宮川 拓也准教授、東京大学の田之倉 優名誉教授の協力を得て、ゼニゴケを用いて、植物の活性酸素種生成酵素RBOH(Respiratory Burst Oxidase Homologues)(*1)の基本的な活性化メカニズムを解明することに成功しました。
活性酸素種(ROS, Reactive Oxygen Species)(*2)は一般に、呼吸や光合成の際に生じる有害な副産物として捉えられてきました。しかし、近年の研究から、多くの真核生物、特に植物ではROSを積極的に生成する酵素系が発達しており、免疫(感染防御)応答をはじめとする生体内のさまざまな生命現象にROSを利用していることが明らかとなってきています。こうした研究に朽津教授らの研究グループも大きく貢献してきました(※1)。ROSは毒性が高いことから、生体内の適切な部位で適切な量を生成するための巧妙な制御機構が存在していると考えられます。カルシウムイオン(Ca2+)の結合と、リン酸化が相乗的に活性化に関与することが2008年に朽津教授らの研究グループによって提唱されましたが、両者の関係など詳細なメカニズムは解明されておらず、世界的にも重要な生物学上の未解決課題となっていました。
本研究では、モデル植物であるゼニゴケ(Marchantia polymorpha)を用いて、微生物由来のキチン(*3)により誘導される感染防御応答時のROS生成メカニズムを調べました。研究の結果、キチンによって細胞内のCa2+濃度上昇が誘導されること、RBOHはCa2+との結合により活性化されること、そしてこのCa2+結合は、陸上植物全般に保存された活性制御領域内に含まれる2つのアミノ酸残基のリン酸化により増強されること、すなわちこの2つのアミノ酸残基のリン酸化によりCa2+が結合しやすくなりRBOHが活性化されることを見出しました。
本研究で解明された基本的なRBOH活性化メカニズムは、陸上植物全般に共通している可能性があり、ROSを介して、病原体に対する免疫、成長や生殖など植物のさまざまな機能を制御するための重要な基礎的知見になると考えられます。
本研究成果は、2023年12月12日に国際学術誌「Physiologia Plantarum」にオンライン掲載されました。
※PR TIMESのシステムでは上付き・下付き文字を使用できないため、化学式や単位記号が正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20240124_7312.html)をご参照ください。
【研究の背景】
本学の朽津教授らの研究グループでは、これまでに植物におけるROSの多種多様な機能を明らかにしてきました(※1)。これまでの研究成果から、RBOHの活性化には、EFハンド(*4)と呼ばれる活性制御領域へのCa2+結合と、さまざまなリン酸化酵素によるリン酸化が重要な役割を果たすことが示唆されていましたが、両者の関係や詳細な活性化メカニズムについては不明のままでした。
さまざまな植物は、微生物由来の特定の分子を認識し、感染防御応答を誘導することにより、病原体の感染に対抗する免疫メカニズムを持ちます。代表的な例として、植物はキチンのような微生物特有の成分(MAMP, Microbe-Associated Molecular Pattern; 微生物関連分子パターン)(*5)を認識すると、RBOHによりROSを積極的に生成し、各種の感染防御応答に利用することが明らかにされています(図1)。
そこで今回、キチンにより誘導される免疫応答時のROS生成に着目し、研究を行いました。
(※1)(過去のプレスリリースの例)
「リグニン合成にはたらく活性酸素種生成酵素RBOHの制御機構は種子植物間で広く保存されている〜活性酸素種を利用した、植物の物質生産への第一歩〜」
https://www.tus.ac.jp/today/archive/20230411_6537.html
「悪役とされる「活性酸素」を上手に使う植物のしくみ 植物の活性酸素種生成酵素タンパク質Rbohの網羅的解析 〜十人十色の酵素が適材適所で活躍する〜」
https://www.tus.ac.jp/today/201902192002.pdf
植物の受精・花粉管の伸長メカニズムの解明: カルシウムイオンにより制御された活性酸素の生成の重要性を発見 ~食糧・環境・エネルギー問題解決の一助となる作物の収量を高める技術開発に向けた一歩~
https://www.tus.ac.jp/today/20140424103836.pdf

図1.植物の感染防御応答の過程では、微生物由来の分子パターンを認識し、RBOHを活性化することにより活性酸素種(ROS)を積極的に生成する。
【研究結果の詳細】
まず、ゼニゴケのMpRBOHBを含むさまざまな植物のRBOHタンパク質のアミノ酸配列を比較解析したところ、N末端側に2つのEFハンドを含む、配列が陸上植物全体で高度に保存された領域(保存ドメイン)が存在することが明らかとなり、活性制御に関与する領域と考えられました。
次に、ヒト培養細胞HEK293Tの異種発現系を用いてゼニゴケのMpRBOHB遺伝子を発現させました。すると、MpRBOHBは他の陸上植物のものと同様に、イオノマイシン(細胞質のCa2+濃度を上昇させる化合物)およびカリクリンA(タンパク質脱リン酸化酵素を阻害し、結果的にタンパク質リン酸化を亢進する化合物)処理により、相乗的に活性化されました。このとき、EFハンド中のCa2+結合に重要な2か所のアミノ酸(G335、G379)を置換したもの(以降、「2xEF変異体」)では、イオノマイシンおよびカリクリンA処理による活性化が著しく抑制されました。
さらに、ゼニゴケを用いて、キチンにより誘導されるROS生成について調べました。Ca2+濃度に応じて蛍光を発するCa2+センサータンパク質をゼニゴケに発現させて、キチン処理によるゼニゴケ細胞内のCa2+濃度変化を調べました。すると、キチン処理によって細胞内への一過性のCa2+流入が見られました。また、MpRBOHB遺伝子をノックアウトしたMprbohB欠損変異体を作製したところ、この変異体ではキチン処理によるROS生成は見られなかったことから、キチン処理によりMpRBOHBが活性化されることがわかりました。そこで、野生型MpRBOHBと2xEF変異体MpRBOHBを用いて、MprbohB欠損変異体に対する相補性解析を行いました。すると、野生型は、MprbohB欠損変異体のROS生成を回復させましたが、2xEF変異体は回復させることができませんでした。この結果は、EFハンドへのCa2+結合が、異種発現系だけでなく、植物体内においてもMpRBOHBの活性化に必要であることを示しています。
切断変異体を用いた実験から、MpRBOHBの活性化には保存ドメインが必要であることが判明したため、保存ドメインのアミノ酸配列を解析しました。すると、保存ドメイン中のセリン残基S223とS406が陸上植物で広く保存されていることがわかりました。そこで、部位特異的変異導入によりS223、S406およびその周辺のセリン残基をアラニンに置換することでリン酸化を阻害しました。すると、この変異体では、カリクリンA処理による活性化が抑制されました。また、S223およびS406をグルタミン酸に置換し、リン酸化状態を模倣した分子構造の変異体(「2xSE変異体」)を作成したところ、この2xSE変異体は、野生型よりも有意に高い活性を示しました(図2)。
さらに、等温滴定型カロリメトリー法を用いて、野生型MpRBOHBと2xSE変異体MpRBOHBのCa2+結合親和性を比較しました。結合親和性を示すKd値(Kd値が低いほど結合しやすいことを示す)は、野生型と比べて2xSE変異体では桁違いに低い値を示し、2xSE変異体が野生型に比べて有意に高いCa2+結合親和性を示す(Ca2+が結合しやすい)ことがわかりました。
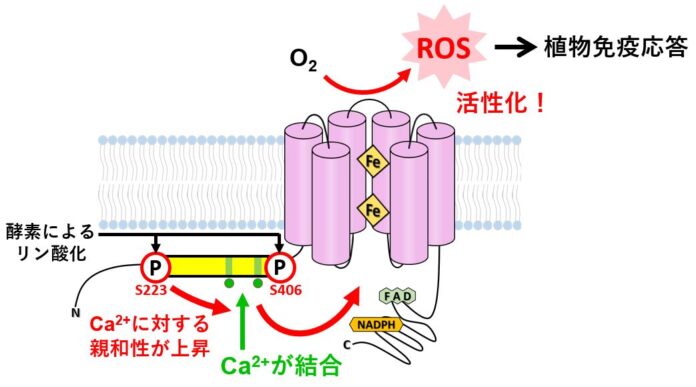
以上の結果から、制御領域の保存ドメイン中2か所のセリン残基S223、S406がリン酸化されることで、MpRBOHBのCa2+結合親和性が増大し、これによりEFハンドへのCa2+結合が増強されて、MpRBOHBが活性化されることがわかりました(図3)。
本研究成果について、朽津教授は、「本研究は、植物が生きる仕組みの理解や植物の機能制御の極めて重要な基礎となる知見です。RBOHによるROS生成は、植物において極めて幅広い重要な機能を担っていますが、いわば毒にも薬にもなるROSの生成を適切に制御する分子的な仕組みが本研究により明らかになったことで、RBOHやROS生成を適切に制御する技術開発の端緒となり、農業や食料、環境、エネルギー問題など、植物が関わる広範な社会的諸問題の解決に寄与できる可能性が期待されます」と、本研究の重要性について述べています。
※本研究は、日本学術振興会科研費(JP26111008、JP20H02990、JP22H04734)の助成を受けて実施したものです。
【用語】
*1 RBOH
細胞膜局在型酵素(NADPHオキシダーゼ)であり、NADPH由来の電子を酸素分子と反応させることで、細胞壁空間に活性酸素種を生成する。
*2 活性酸素種(ROS)
酸素分子(O2)と水(H2O)との間の酸化還元状態に位置する反応性の高い分子群で、スーパーオキシドアニオンラジカル(・O2−)、過酸化水素(H2O2)、ヒドロキシルラジカル(・OH)などが含まれる。生体内では、DNAやタンパク質など種々の生体分子と反応することで細胞毒性を示す一方、さまざまな生命現象におけるシグナル分子として利用されている。
*3 キチン
カビなど真菌類の細胞壁を構成する糖鎖。植物が持つキチン分解酵素(キチナーゼ)により遊離したその断片であるオリゴ糖は、代表的なMAMP(微生物分子パターン; *5)として、植物に感染防御(免疫)応答を引き起こす。
*4 EFハンド
多くのカルシウムイオン(Ca2+)結合タンパク質に見られる特徴的な部分構造(モチーフ)であり、2つのヘリックス(らせん状構造)がループで繋がれた構造をしている。Ca2+と特異的に結合する。
*5 MAMP
多くの微生物に共通する特有の成分。植物はパターン認識受容体を介してMAMPを認識することで、感染防御応答を開始する。

図2.ゼニゴケの活性酸素種(ROS)生成酵素MpRBOHBの活性に対するCa2+濃度の影響
動物培養細胞にMpRBOHBを発現させ、ROS生成活性を測定した。リン酸化模倣体(2xSE変異体)は野生型よりも低いCa2+濃度で活性化されたことから、リン酸化によりCa2+に対する感受性が向上することが示唆された。

図3.Ca2+結合とリン酸化によるRBOH活性化のモデル
陸上植物に高度に保存された領域(黄色の部分)は、2か所のCa2+結合部位(緑色の部分)を含む。Ca2+が結合しないと、RBOHは活性化されず、活性酸素種(ROS)の生成にはCa2+結合部位へのCa2+の結合が必須である。2か所のセリン残基(赤字)がリン酸化されると、Ca2+の結合親和性が高まる(Ca2+が結合しやすくなる)。
【論文情報】
雑誌名:Physiologia Plantarum
論文タイトル:Enhanced Ca2+ binding to EF-hands through phosphorylation of conserved Serine residues activates MpRBOHB and chitin-triggered ROS production
著者:Takafumi Hashimoto, Kenji Hashimoto, Hiroki Shindo, Shoko Tsuboyama, Takuya Miyakawa, Masaru Tanokura, Kazuyuki Kuchitsu
DOI:10.1111/ppl.14101
URL:https://doi.org/10.1111/ppl.14101
※本論文はオープンアクセスですので、どなたでもお読みいただけます。